Los productos IVD son dispositivos y sistemas que se utilizan para diagnosticar, tratar o prevenir condiciones de salud. Están destinados a ser utilizados en la recolección y el examen de muestras biológicas como sangre, saliva o tejido. Las muestras se pueden tomar del interior de la nariz o de la parte posterior de la garganta, o de una vena o una punción en el dedo.
Es importante tener en cuenta que los productos IVD no son invasivos. Por ejemplo,
el analizador de inmunoensayo de quimioluminiscencia homogéneo Poclight HSCL-5000 Micro
.
Sin embargo, todavía se consideran dispositivos médicos y, por lo tanto, están sujetos a los mismos controles. Los dispositivos médicos consisten en cualquier instrumento, aparato, software o dispositivo relacionado destinado a ser utilizado por seres humanos con el propósito de:
·
Diagnosticar, prevenir, controlar o tratar enfermedades o lesiones.
·
Apoyar o sustentar la vida.
·
Regulación de la concepción.
·
Desinfección de dispositivos médicos.
·
Proporcionar información con fines médicos mediante la recogida de muestras biológicas de seres humanos.
Los fabricantes de diagnósticos in vitro deben cumplir con los requisitos reglamentarios de la Unión Europea, el Reino Unido y los EE. UU., según los mercados en los que deseen ingresar.
Estos requisitos incluyen el Reglamento de diagnóstico in vitro (IVDR) (UE) 2017/746 en la UE y el Reglamento de dispositivos médicos del Reino Unido (UK MDR) 2002 en el Reino Unido. En los Estados Unidos, los productos IVD se definen en la sección 201(h) de la Ley Federal de Alimentos, Medicamentos y Cosméticos (Ley FD&C); estos dispositivos también pueden estar sujetos a la sección 351 de la Ley de Servicios de Salud Pública, así como a la categorización bajo las Enmiendas de Mejora de Laboratorio Clínico (CLIA) de 1988.
Según el IVDR, un producto IVD se define como “cualquier dispositivo médico que sea un reactivo, producto reactivo, calibrador, material de control, kit, instrumento, aparato, pieza de equipo, software o sistema, ya sea que se use solo o en combinación, destinado por el fabricante para su uso in vitro para el examen de muestras, incluidas las donaciones de sangre y tejidos, derivadas del cuerpo humano…”
Los expertos estiman que aproximadamente el 70 % de todas las decisiones clínicas se toman con productos IVD.
Ejemplos de productos IVD
Las pruebas de embarazo, las pruebas de COVID-19 y las pruebas de VIH son ejemplos de productos IVD. Otros ejemplos de dispositivos Poclight HSCL-5000 Micro CLIA Analyzer IVD incluyen:
·
Diagnóstico del cáncer
· Diagnóstico de tiroides
· Diagnóstico de inflamación
·
Inmunoensayos
· ...
Los receptáculos fabricados para muestras médicas también son productos IVD. Según la Organización Mundial de la Salud, hoy en día hay más de 40 000 productos disponibles para pruebas IVD. Estos pueden variar desde pruebas de laboratorio tradicionales hasta pruebas en el punto de atención.
Clasificación IVD
En los Estados Unidos, la FDA clasifica todos los dispositivos médicos, incluidos los productos IVD, como Clase I, Clase II o Clase III. La clasificación del dispositivo variará según el riesgo involucrado y el nivel de control regulatorio necesario para garantizar la seguridad del producto. En consecuencia, la clasificación IVD determinará el proceso previo a la comercialización que el fabricante debe seguir para llevar su producto al mercado.
·
Los productos de Clase I se consideran de riesgo bajo a moderado y requieren controles generales.
·
Los productos Clase II se consideran de riesgo moderado a alto y requieren controles generales y Controles Especiales.
·
Los productos de clase III se consideran de alto riesgo y requieren controles generales y aprobación previa a la comercialización (PMA).
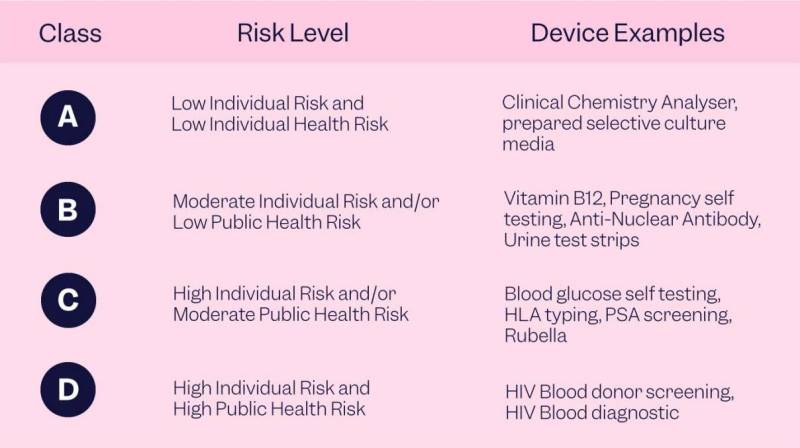
Es importante tener en cuenta que a medida que aumenta la clase de dispositivo, también aumentan los controles reglamentarios. Los dispositivos IVR de Clase I están sujetos al control regulatorio mínimo, mientras que los dispositivos IVR de Clase III cuentan con los requisitos más estrictos. Las empresas de ciencias de la vida que deseen comercializar sus productos de diagnóstico in vitro en los Estados Unidos pueden consultar el recurso "Clasifique su dispositivo médico" de la FDA.
¿Busca garantizar el cumplimiento normativo en la Unión Europea? El IVDR se actualizó en 2021 para incluir mejoras como:
·
Obligaciones claras para fabricantes, importadores y distribuidores relacionadas con la trazabilidad, el registro y la verificación del etiquetado adecuado de los dispositivos. Esto incluye un sistema de trazabilidad basado en un identificador único de dispositivo (UDI).
·
Introducción de una clasificación compuesta por cuatro clases de riesgo. Los dispositivos de clase A presentan un riesgo individual y de salud pública bajo, los dispositivos de clase B presentan un riesgo individual moderado y/o de salud pública bajo, los dispositivos de clase C presentan un riesgo individual alto y/o un riesgo de salud pública moderado, y los dispositivos de clase D presentan un riesgo individual alto y de salud pública alto. riesgo para la salud pública.
·
Controles más estrictos para dispositivos IVD de alto riesgo.
·
Supervisión garantizada de los organismos notificados (u organismos independientes de evaluación de la conformidad de terceros) mediante el refuerzo de un conjunto específico de criterios.
·
Mayor transparencia con una base de datos completa sobre dispositivos médicos en la UE (llamada EUDAMED).
·
Normas reforzadas sobre pruebas clínicas y evaluación del rendimiento, con una mayor coordinación entre los países de la UE, especialmente en lo que respecta a la vigilancia del mercado.
·
Requisitos más estrictos de vigilancia posterior a la comercialización del fabricante.
·
Requisitos específicos para "dispositivos internos" o productos IVD fabricados y utilizados dentro de la misma institución.
Llevar un producto IVD al mercado de manera segura y efectiva es clave, y comprender las regulaciones vigentes es un primer paso ideal.
Conclusión
Los productos IVD son una línea crítica de defensa contra varias condiciones de salud. La seguridad y la calidad de los diagnósticos in vitro son esenciales, razón por la cual el cumplimiento normativo del fabricante es tan importante. Poclight cuenta con las certificaciones CE e ISO y cuenta con una gama completa de reactivos para realizar las pruebas sin preocupaciones.

 English
English français
français русский
русский español
español português
português العربية
العربية 日本語
日本語 Türkçe
Türkçe हिंदी
हिंदी Indonesia
Indonesia 







 Network IPv6 compatible con |
Network IPv6 compatible con | 